 Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)  Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
L'oxygène singulet et la vie : partie A- Généralités
C Deby
A.1. Introduction historique
Nous avons vu dans le tome I de l'Initiation au métabolisme de l’oxygène (chapitre XI) que l'oxygène singulet est un état excité de l'oxygène fondamental. A l'inverse de celui-ci, tous les électrons de sa couronne externe (outer shell) sont pairés.
Jusqu'en 1964, l'oxygène singulet, 1Δg, n'avait présenté d'intérêt que pour les astrophysiciens. Les recherches spectroscopiques de cette forme d'oxygène excité, découverte en 1924 et qui se forme dans la haute atmosphère au cours des aurores boréales (fig. 1), avaient commencé en 1931. L'astrophysicien et prix Nobel Herzberg découvrit en 1934, dans le spectre solaire infra-rouge, une raie à 12900 angströms qu'il attribua à un état excité de l'oxygène correspondant à l'oxygène singulet1.

Fig.1: Luminescence rouge au cours d'une aurore boréale.
En 1927, un chimiste français, Mallet, avait montré que l'anion OCl- réagit avec le peroxyde d'hydrogène en provoquant un dégagement d'oxygène; cette réaction s'accompagne d'une très faible luminescence rouge foncé. L'équation suivante fut proposée :
![]() (I)
(I)
Mais l'expérience de Mallet, pour permettre l'observation à l'oeil nu de la luminescence, exige des concentrations de réactifs élevées2. La figure 2 montre l'appareillage : un flux de chlore barbotte dans du peroxyde d'hydrogène 8 M (perhydrol) et l'observation se fait à l'obscurité.
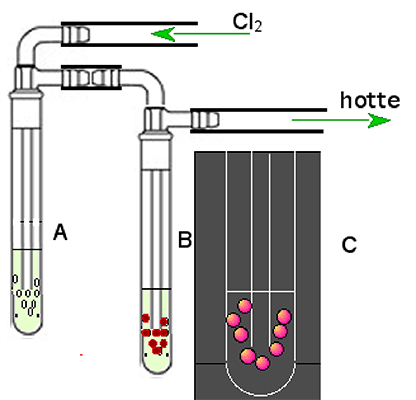
Fig. 2 : Expérience de Mallet (1927). A . Flacon laveur contenant NaOH 4 N. B. Flacon laveur contenant NaOH 4 N + H2O2. C. Observation du flacon B dans l'obscurité: les bulles émettent une luminescence rougeâtre. |
L'équation (I) s'écrit alors :
 (II)
(II)
Plus tard, on suggéra que la chimiluminescence rouge sombre accompagnant la réaction de Mallet témoigne d'un état d'excitation des molécules réagissantes qui se désexcitent par émission lumineuse3.
En 1963 et 1964, Khan et Kasha reproduisirent l'expérience de Mallet et en étudièrent la luminescence au spectroscope. Ils montrèrent des similitudes spectroscopiques entre ce phénomène et les caractéristiques de l'oxygène singulet observé en haute atmosphère4,5. Ils identifièrent ainsi 1Δg pour la première fois dans un système chimique qui était celui de la réaction découverte par Mallet en 1927. L'équation (II) devait s'écrire :
 (III)
(III)
Divers travaux, menés entre 1964 et 1966, établirent que 1Δg peut se produire durant des réactions chimiques diverses et que cette espèce apparaît en milieu aqueux de manière très fugace. "La chemiluminescence qui survient au cours de réactions d'oxydation de molécules organiques est associée à l'excitation d'états métastables de l'oxygène moléculaire, en systèmes peroxydés"6.
Entre 1968 et 1970, Foote attira l'attention sur l'importance de 1Δg en biologie et découvrit un "quencheur" naturel de celui-ci, le carotène beta7,8. En 1970, le rôle de l'oxygène singulet 1Δg dans la carcinogenèse et le vieillissement et sa toxicité manifeste furent soulignés au cours d'une conférence internationale qui lui fut consacrée. Durant cette session, il fut montré que, vis-à-vis des acides gras non saturés, l'oxygène singulet est plus de mille fois plus actif pour former des peroxydes que l'oxygène fondamental9. Kasha et Khan déclarèrent: "L'oxygène singulet, qui a été négligé parce que n'ayant d'intérêt que pour les astrophysiciens, doit être maintenant considéré comme un intermédiaire universel possible dans les processus physiques, chimiques et biologiques impliquant l'oxygène moléculaire"10. La paternité de l'oxygène singulet dans les systèmes biologiques fut attribuée à une dismutation de l'anion superoxyde, grande vedette en ces années 197011 (Voir plus loin en B.2.1.1 l'évolution de ce concept).
A.2. Rappel sur les formes de O2
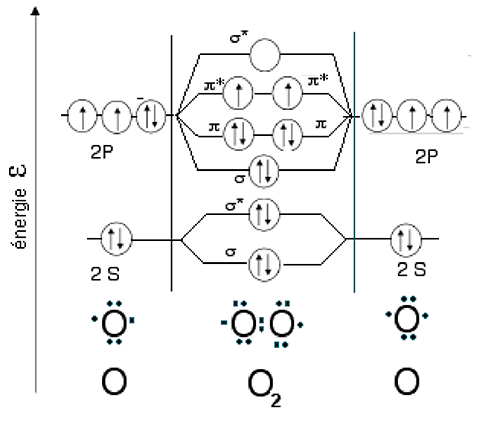
Fig. 3 : Hybridation de deux atomes d'oxygène O pour former O2. Les électrons 1S ne sont pas représentés.
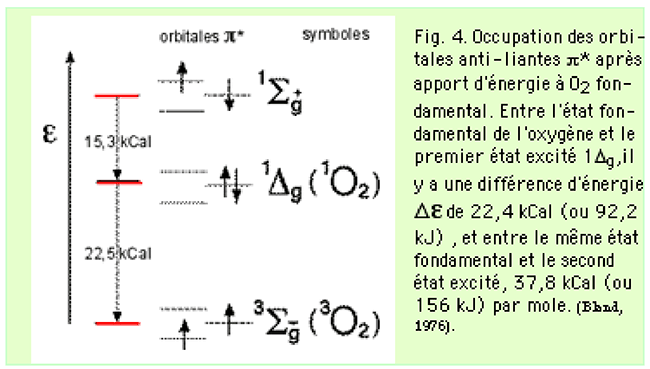
L'oxygène existe, à l'état singulet, sous 2 formes métastables dont l'une, 1Σg+, a une durée de vie beaucoup plus brève que l'autre, 1Δg (fig.4). Le futur Prix Nobel Mulliken12 prédit l'existence de ces deux formes qui furent effectivement observées l'année suivante par Ellis et Kneser13.
A.3. Modes de formation de 1Δg in vitro
A.3.1. Par réactions photo-sensibilisées: on utilise des colorants sensibilisateurs qui, sous l'action d'une lumière visible, sont amenés de l'état fondamental à un état excité (voir fig. 14 A et 14 B); ils se désexcitent en présence d'O2 qui capte l'excès énergétique et passe à l'état singulet (fig.5 ). L'excitation consiste en un saut d'un électron faisant partie d'une paire dans une orbitale de basse énergie vers une orbitale vide de haute énergie. Le spin de cet électron peut garder son orientation, la molécule restant singulet, ou subir une inversion : la molécule devient un triplet .
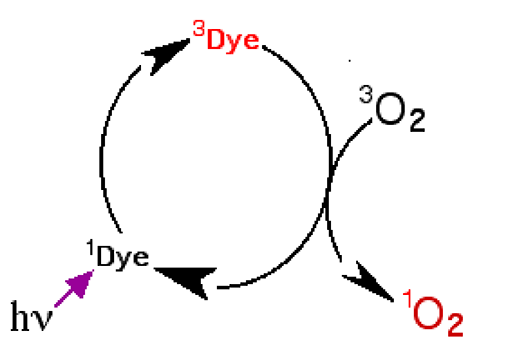
| Fig. 5 : Le colorant à l'état fondamental (1Dye: singulet) est excité et passe à l'état triplet (3Dye). Il se désexcite en transférant son énergie à l'oxygène fondamental qui devient singulet, tandis que l'électron retourne sur son orbitale primitive (de basse énergie). |
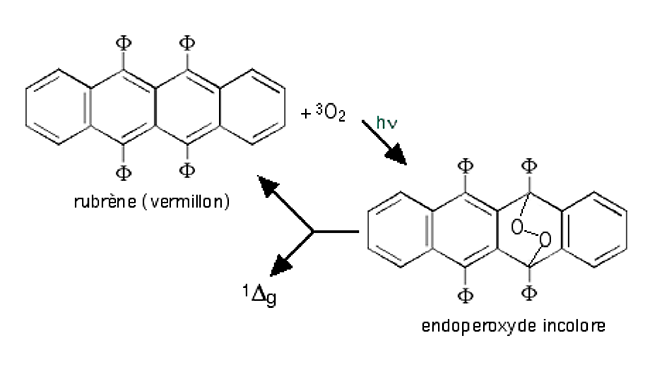
| Fig. 5 bis : Une des premières réactions photochimiques connues comme produisant l'oxygène singulet14. La décomposition de l'endoperoxyde avec retour au rubrène exige un chauffage sous vide; elle s'accompagne d'une phosphorescence rouge. |
Pour être efficace, le sensibilisateur doit pouvoir rester longtemps à l'état excité. Ce n'est pas le cas s'il reste singulet: il retombe rapidement sur son orbitale de départ. Par contre, s'il devient triplet, le retour sera quantiquement interdit (loi de conservation de spin) et l'échange d'énergie entre le triplet et 3O2 aura plus de chance de se produire. Parmi les porphyrines, c'est surtout la protoporphyrine IX [PP(IX)] qui capte aisément les rayonnements lumineux de basse énergie en passant à l'état triplet15. Pour Dalton et McAuliffe, les réactions suivantes auraient lieu :
a) PP(IX) + hν → PP(IX)*
b) PP(IX)* + 3O2 → PP(IX) + 1Δg
Elles se produiraient de manière certaine dans les milieux biologiques contenant de la protoporphyrine IX et exposés à la lumière15.
On a employé notamment: la tétraphénylporphyrine (fig. 6), le rose Bengale (fig. 7), le bleu de méthylène (fig. 8), l'éosine, la fluorescéine, la bilirubine16, la violanthrone (fig. 9), la phtalocyanine (fig. 10), etc …17. La bilirubine serait la substance la plus photo-active dans l'environnement lipidique naturel17. Pour l'obtention de taux élevés de 1Δg, les irradiations sont produites par des "flash" laser ("giant pulses")18 ou par des radiofréquences19.
Fig. 6 : Tétraphénylporphyrine Fig. 7 : Rose Bengale
Fig. 8 : Bleu de méthylène
Fig. 9 : Violanthrone
Fig. 10 : Phtalocyanine
A.3.2. Par conversion thermique : à première vue, cette conversion n'apparaît pas aisée puisqu'un facteur d'entropie important doit intervenir dans le passage de l'état à 2 électrons à spins parallèles vers l'état à 2 électrons pairés. Ce passage se produit facilement lors du chauffage à l'obscurité d'un mélange oxygène triplet/acétylène, avec formation d'un complexe triplet doué de propriétés catalytiques20.
D'usage plus aisé est la décomposition par chauffage d'endoperoxydes aromatiques (fig. 11 et 12)21.
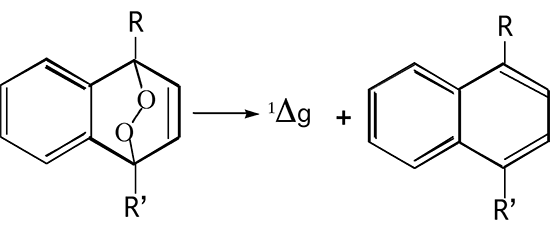
Fig. 11: Production de 1Δg à partir d'un endoperoxyde: schéma général.
Fig. 12 : Production de 1Δg à partir d'un endoperoxyde anthracénique.
A.3.3. Par réactions chimiques :
A.3.3.a. Réaction de Mallet (équation III)
A.3.3.b. Par décomposition du perchromate de K22:
4CrO83- + 2H2O → 4CrO42- + 71Δg + 4OH- (IV)
A.3.3.c. A partir du 1-phospho-2,8,9-trioxaadamantane ozonide23,24
A.3.3.d. Au cours de la dismutation de l'anion superoxyde
En 1987, le prix Nobel Corey affirma avoir mis en évidence, par spectroscopie à 1260 nm, la formation de 1Δg par introduction d'eau dans une suspension de KO2 en solvants aprotiques25. Khan et Kasha26, en produisant de l'anion superoxyde par réaction de H2O2 avec le superoxyde de K dissous par un éther-couronne en milieu aprotique, ont montré l'apparition d'une chimioluminescence centrée sur 1268 nm, caractéristique de 1Δg.
Ces travaux ont toutefois été contestés en 2000 par Martinez et al.27 qui ont argué de l'impossibilité thermodynamique de la réaction O2- + H2O2 : celle-ci a en effet une énergie de Gibbs positive et, de plus, la vitesse de dismutation de O2- est beaucoup plus grande que ne serait celle produisant 1Δg. La controverse n'est certainement pas finie (voir B.2.1.1: la controverse sur la formation de 1Δg à partir de O2-, in vivo).
A.3.3.e. Réaction du peroxynitrite avec H2O2
Ce sujet a été l'objet d'âpres discussions depuis la publication par Di Mascio et al. en 199428 de l'équation :
ONOO- + H2O2 → 1Δg + -OH + HNO2 (pH>7,5) (V)
Dans ces conditions, le peroxynitrite devrait libérer une énergie supérieure aux 22 kCal requises pour exciter O2 et en faire de l'oxygène singulet.
Les auteurs montrèrent que la réaction de H2O2 avec le peroxynitrite, dans un milieu de pH>7, produit un pic de chimiluminescence à 1270 nm, amplifié par la présence de D2O et "quenché" par l'azide de Na. Ces phénomènes impliquaient une grande probabilité de formation de 1Δg (voir B.1).
Mais des travaux rigoureux furent menés sous la direction de Koppenol auxquels participèrent Di Mascio et al28. Se basant sur des calculs thermodynamiques et quantiques, cette nouvelle équipe démontra l'impossibilité énergétique d'une transformation de ONOO- en 1Δg et Di Mascio reconnut s'être trompé.
Néanmoins, Khan29 avait observé que l'acidification de ONOO- (obtenu par réaction de O2- + NO•) produit également une émission infra-rouge à 1270 nm, impliquant elle aussi la formation de 1Δg. Mais dans ce cas également, c'est l'existence dans le milieu de préparation de H2O2, provenant de la dismutation spontanée de O2-, qui nous ramène à l'équation de Di Mascio proposée en 1994, et aux mêmes critiques formulées à son égard27. Sans désemparer, en 2000, Khan et al.30 proposèrent que la décomposition de ONOO- en tampon phosphate neutre, produit 1Δg et l'anion nitroxyle NO- (fig.13). A nouveau, les travaux de Martinez et al.27 expliquèrent les résultats obtenus par Khan et al. par une contamination par H2O2 du peroxynitrite utilisé, niant ainsi l'hypothèse de Khan, par retour aux cas évoqués ci-dessus.
A.3.3.f. Génération par l'ozone: proposée par Chow31, par Murray et al.32 et par Kanofsky33.
Kanofsky a montré que diverses fonctions organiques réagissent avec O3 pour produire 1Δg. Il s'agit surtout de thiols :
![]() (VI)
(VI)
Outre la méthionine, la cystéine et le glutathion peuvent participer à cette réaction. L'acide ascorbique réagit avec l'ozone pour créer 0.61 mole de 1Δg par mole d'O333
A.3.3.g. Décomposition des peroxydes organiques : envisagée surtout in vivo; voir B.2.1.3
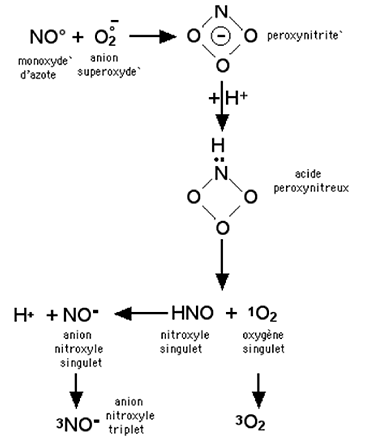
Fig. 13 : D'après Khan et al.30 : évolution au cours de l'abaissement du pH, phénomène contesté par Martinez et al.27
A.4. Chimiluminescence (CL) de l'oxygène singulet
A.4.1. Rappel de notions fondamentales sur les luminescences
(inspirées de P.Suppan, 1994, réf. 34)
Les émissions de luminescence correspondent à des transitions avec perte d’énergie. Dans une molécule excitée, un électron de basse énergie "saute" sur une orbitale de plus haute énergie, absorbant l'excès d’énergie. Après un temps, l'électron revient sur son orbitale de départ, en émettant un photon hν : restitution au milieu de l'excès d'énergie fourni à la molécule.
On distingue deux types de luminescence, selon le temps avec lequel le phénomène disparaît : la fluorescence et la phosphorescence.
A.4.1.a. La fluorescence : l'excès d'énergie correspond à l'absorption d'un photon incident hνi (fig 14A). En moins de 10-8 sec, la molécule retourne à l'état fondamental, avec émission d'un photon de fluorescence hνf de direction perpendiculaire au rayonnement d'excitation. La briéveté s'explique par le fait que le spin de l'électron mobilisé est resté inchangé.
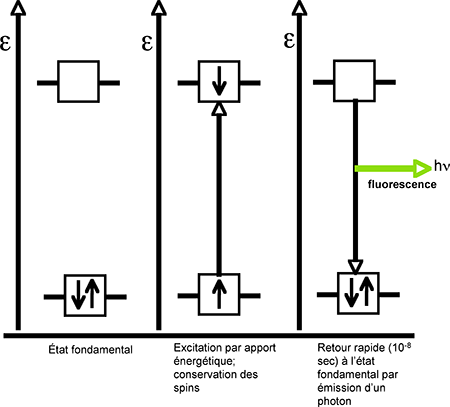
Fig. 14A : La fluorescence.
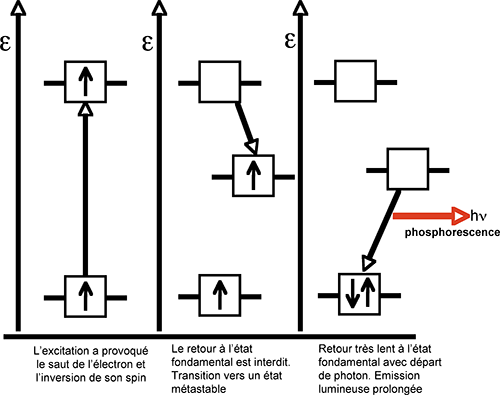
Fig. 14B : La phosphorescence: diagramme de Jablonski simplifié.
A.4.1.b. La phosphorescence : le spin de l'électron éjecté de son orbitale de faible énergie bascule et la molécule devient un triplet (fig 14B). Le retour à l'état initial est très fortement ralenti (règle d'interdiction de spin). Un état métastable est créé, caractérisé par un niveau d'énergie intermédiaire. Les molécules triplets retourneront à l'état primitif par émission lente et relativement faible de photons. La phosphorescence peut durer plusieurs heures après l'excitation.
A.4.2. Luminescence de l'oxygène singulet
Il s'agit de phosphorescence.
Il faut d'abord rappeler que la plus grande partie des molécules de 1Δg se désexcitent sans CL (quenching par solvant) : décroissance "radiationless"35 (fig.15).
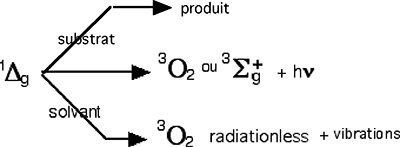
Fig. 15 : Devenir de l'oxygène singulet.
Il existe deux types de phosphorescence (CL) pour 1Δg36.
A.4.2.a. CL monomolaire : elle correspond à la décroissance d'énergie d'une molécule de 1Δg et le photon émis a une longueur d'onde λ= 1270 nm (fig.16).
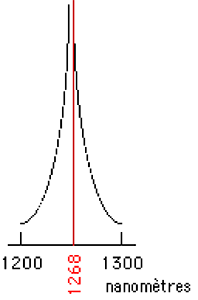
Fig. 16 : Longueur d'onde d'émission de l'oxygène singulet (d'après Khan, 1984, réf 37).
Ce phénomène est de très faible amplitude, car cette voie de décroissance est quantiquement interdite (réf 29 et fig. 14B) et ne se produit qu'avec une fréquence (nombre de molécules décroissantes par unité de temps) très faible. Seule une faible fraction de 1Δg (10-3 à 10-6M) est soumise à ce type de décroissance radiative. Mais cette émission à 1270 nanomètres est caractéristique de la présence de 1Δg et sa détection permet d'affirmer la présence de 1Δg. La perte d'énergie résulte de collisions de 1Δg avec des molécules de solvant36.
A.4.2.b. CL bimolaire : elle résulte de la décroissance d'oxygène singulet dimolaire (1,2) (fig.15).
La collision entre deux molécules d'oxygène singulet forme une sorte de "dimère" dont les molécules se désexcitent avec émission de 2 radiations (fig. 17).
1Δg + 1Δg → [1Δg-1Δg]* → 3O2 + 3O2 + hν (λ= 630 et 703 nm) (VII).
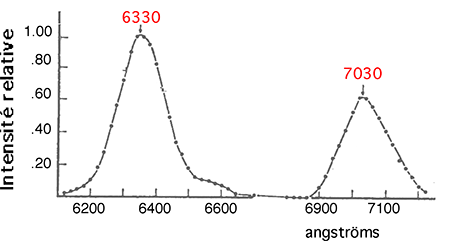
Fig. 17 : Luminescence "dimolaire" de l'oxygène singulet (d'après Seliger,1964, réf. 38).
La luminescence "dimolaire" de 1Δg s'observe dans la production de cette espèce par photosensibilisateurs36; elle est augmentée par le DABCO (voir B.1.3.c.)39,40. Mais ce type de CL n'est pas forcément dû à l'oxygène singulet (voir A.4.3 et B.1.) et ne constitue pas une caractéristique spécifique.
A.4.3. CL parasite : l'énergie de désactivation de 1Δg est transmise à un "quencheur" (voir A.5.1) qui après activation, revient à l'état fondamental en émettant une radiation qui lui est propre. Mallet (1928) a le premier constaté cette amplification de la luminescence, durant la réaction qui porte son nom, en utilisant divers réactifs cycliques : anthracène, acridine, quinine, ou esculine. La luminescence est intense et située dans le bleu ou le violet. Plus tard, on utilisa le luminol41 ou la violanthrone. Ces émissions ne sont jamais une preuve de formation d'oxygène singulet, mais d'une libération d'énergie qui excite ces molécules42.
A.5. Propriétés chimiques de l'oxygène singulet
Le fait le plus remarquable est que l'oxygène, en devenant un singulet, perd son inertie vis-à-vis des molécules organiques, des singulets pour la plupart.
L'interdiction quantique des réactions singulet vs triplet n'est plus applicable. Ainsi, le rendement de la réaction de 3O2 avec l'acide linoléique est 8,9.101M-1sec-1. Dans le cas de 1Δg, il devient 1,3.105M-1sec-1, soit environ 1500 fois plus abondant.
La chimie de l'oxygène singulet s'est fortement développée depuis les travaux de base des années soixante, tels ceux de Foote et al. et ceux de Khan et Kasha. Nous ne décrirons ici que les réactions susceptibles de se produire en milieux biologiques. Pour plus de considérations purement chimiques, nous suggérons au lecteur de consulter les références 43-48.
A.5.1. Désactivation de l'oxygène singulet (Quenching)
La décroissance de 1Δg est la résultante d'une compétition entre trois catégories de phénomènes48
a) réaction chimique de l'oxygène singulet avec une molécule : voir ci-dessous,
b) phénomènes de quenching physique "radiationless" : transfert d'énergie vers une molécule sans altérer la nature chimique de celle-ci,
c) désactivation radiative avec émission de photons.
1O2 → 3O2 + hν (1260 nm) (VIII) : désexcitation spontanée
(1O2)(1O2) → 2 3O2 (IX) : résultat d'une collision entre 2 molécules de 1O2
Il est évident que lorsque sa vitesse de décroissance est trop rapide, l'oxygène singulet a une réactivité chimique diminuée, et inversément.
Un grand nombre de "quencheurs" de 1Δg ont été synthétisés49.
Nous allons examiner les mécanismes de quenching physique "radiationless" (sans émission de photon).
A.5.1.a. Quenching physique par conversion e → v de l'énergie d'excitation électronique e de l'électron π* en énergie vibrationnelle v qui est transmise à la molécule quencheuse (le solvant par ex). Le retour de 1Δg à l'état stable 3O2 peut s'effectuer par transfert énergétique aux molécules du solvant35,50.
1Δg + S → 3O2 + Sexcité (élévation de la température) (X)
Ce processus dépend énormément du solvant : ce sont les solvants de fréquence vibrationnelle les plus élevées qui produisent la relaxation la plus rapide46. Wilkinson et al.51 ont publié une volumineuse compilation des constantes de décroissance de 1Δg selon les milieux solvants. L'eau H-OH a une forte énergie vibrationnelle qui rend la durée d'existence de 1Δg très courte; l'eau deutérée D2O a une énergie nettement plus faible, ce qui permet une durée de 1Δg 10 fois plus longue (fig. 18).

Fig. 18 : Quelques durées d'existence de 1Δg selon les solvants.
Ainsi s'explique l'usage de l'eau deutérée, D2O, dans la recherche de 1Δg dans un système (voir B.1.2.). On utilise aussi couramment le méthanol deutéré : CD3OD.
A.5.1.b. Quenching physique par transfert de charge (CT)
1O2 et le quencheur se rapprochent par transfert d'un électron vers le pôle électrophile de la molécule d'oxygène, en formant un exciplexe de courte vie :
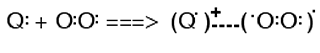 (XI)
(XI)
A la fin de la réaction, l'agent quencheur se retrouve inchangé.
Ainsi agit le tétraméthyléthylène52 (fig. 19).
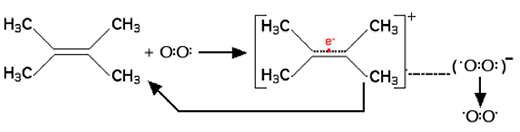
Fig. 19 : Catalyse du quenching de 1Δg.
Il faut que l'énergie d'ionisation du composé quencheur soit suffisamment basse. C'est également le cas du DABCO (fig. 36 et 37) qui permet le réarrangement électronique dans la molécule de 3O2 tout en retrouvant finalement sa nature première par retour de l'électron (voir ci-dessous : DABCO B.1.3.c.).
A.5.1.c. Quenching par transfert de l'énergie électronique: EET (Electronic Energy Transfer)
C'est un processus rapide de désactivation, limité par la vitesse de diffusion. C'est le cas du carotène (voir plus loin: B.1.3.a.)8.
Carot + 1O2 → 3Carot + 3O2 (XII)
Quant à la désactivation radiative, la plus intéressante, parce que la plus spécifique de 1O2, est celle qui permet l'émission d'un photon de λ = 1260 nm. Mais cette transition est interdite par la règle de conservation de spin. Elle se produit donc peu fréquemment, d'où la nécessité de recourir à des procédés de détection lumineuse extrêmement sensibles (Voir B.1.1.).
A.5.1.d. Conclusions sur la stabilité et la durée de vie de 1Δg
De par sa très haute réactivité et de par le phénomène d"'auto-quenching" par collision, la durée de vie de 1Δg est extrêmement brève et extrêmement dépendante de la nature du milieu où il est dissous (plus de six ordres de magnitude entre les vitesses extrêmes mesurées dans les divers solvants). Rappelons que ce sont les solvants de fréquence vibrationnelle les plus élevées qui permettront la disparition la plus rapide de 1Δg.
Il y a donc compétition entre :
- la réactivité chimique de 1Δg, régie par la vitesse de diffusion,
et
- la rapidité de décroissance.
Si la décroissance est ralentie, le rendement des réactions chimiques induites par 1Δg sera évidemment augmenté (effet positif de l'eau deutérée sur les réactions de 1Δg). L'existence de 1Δg au sein des membranes cellulaires, aprotiques, est plus longue qu'en phase aqueuse.
Comme nous l'avons vu plus haut (A.5.1.a.), il existe des tables qui collationnent les durées de vie de l'oxygène singulet dans différents milieux solvants51.
La durée de vie τ de 1Δg, en présence d'un quencher, est mesurable par l'application de l'équation de Stern-Volmer,
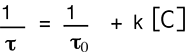
τo étant la durée de vie sans quencheur et C la concentration molaire.
A.5.2. Propriétés chimiques biologiquement importantes de l'oxygène singulet
Les auteurs s'accordent pour considérer l'oxygène singulet comme un réactif électrophilique puissant, mais régio-et stéréo-spécifique47.
A.5.2.1. Généralités
L'oxygène singulet est capable d'oxyder, sans catalyse, diverses molécules biologiquement importantes. Quatre types de réactions intéressent les biochimistes et biologistes :
1) les cycloadditions 4+2 (Diels-Alder)
2) les ène réactions (réactions de Schenck)
3) les cycloadditions 2 + 2
4) les cycloadditions 1,4
Les schémas qui suivent sont inspirés par Foote et Clennan47.
A.5.2.1.a. Réactions selon Diels-Alder ou 4+2 cycloadditions
Ces réactions se produisent entre un composé électrophile et des cis-diènes conjugués donneurs d'électrons. Elles ne sont pas concertées : elles s'accomplissent par étapes (diradical, zwitterion, etc)53. L'exemple classique est celui de la réaction de la fig. 20 entre l'éthylène (électrophile) et le butadiène (diène conjugué)47.
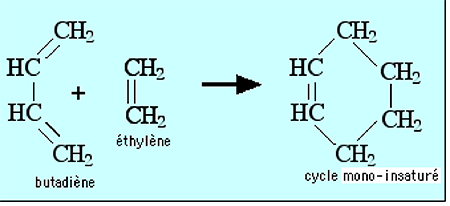
Fig. 20 : Exemple de réaction de Diels -Alder : un diène conjugué (butadiène) réagit avec un diénophile (éthylène).
L'oxygène singulet a une distribution électronique voisine de celle de l'éthylène. Comme cette molécule, c'est un diénophile puissant qui participe aux réactions de Diels-Alder. En effet, 1Δg peut s'écrire O=O, écriture qui met en valeur le déficit d'électrons de sa structure électronique54, comme le montre la fig. 21. L'analogie éthylène vs 1Δg apparaît sur la fig. 22. Mais 1Δg est encore plus électrophile que l'éthylène54.
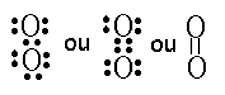
Fig. 21 : Manière d'écrire la formule de 1Δg, mettant en évidence le déficit électronique.
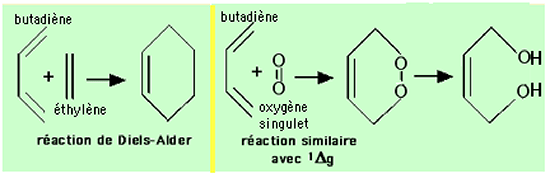
| Fig. 22 : Schématisation de l'analogie éthylène/oxygène singulet. A gauche, un diène conjugué réagit avec l'éthylène pour former un cycle insaturé. A droite, le diène conjugué réagit avec 1Δg pour former un hétérocycle mono-insaturé instable, qui se stabilise en devenant un diol mono-insaturé. |
A.5.2.1.b. Réactions du type 2+2 (ou 1,2-cycloadditions)
Elles
forment des dioxétanes instables55. Ce sont des réactions non concertées (fig. 23 A et B).
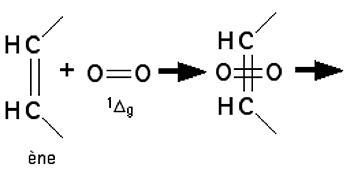
Fig. 23A : Réaction 2+2 conduisant aux dioxétanes instables.
Ce type de réactions se produit notamment dans les réactions photochimiques53. Les dioxétanes se décomposent en carbonyls triplets56. Plus récemment, Timmins et al (1997) ont montré que la fragmentation de dioxétanes produisait de l'acétone triplet57.
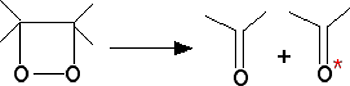
Fig. 23B : La décomposition du dioxétane produit 2 molécules d'acétone, dont l'une est triplet (astérisque rouge).
A.5.2.1.c. Les ènes réactions (type : réaction de Schenk)
La fig. 24 donne le schéma général de ce type de réactions et la fig. 25 en est une application. Ce sont des réactions concertées.
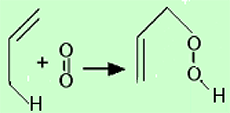
Fig. 24 : Réaction "ène" de l'oxygène singulet avec un mono-ène.
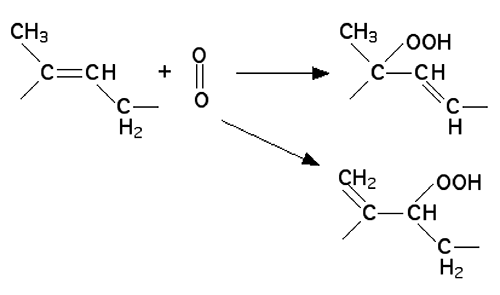
Fig. 25 : L'attaque d'une structure allylique par 1Δg produit un hydroperoxyde allylique sous forme de 2 isomères47.
A.5.2.1.d. Les 1,4-cycloadditions
Elles produisent des endoperoxydes (fig. 26).
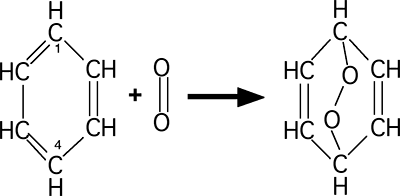
Fig. 26 : L'oxygène singulet s'insère entre les carbones 1 et 4.
A.5.2.1.e. Quelques cas particuliers
1Δg réagit avec de nombreuses molécules importantes des cellules : bases nucléiques, lipides non saturés, amino-acides.
L'histidine : elle fut considérée durant les années 70 comme le piègeur spécifique de 1Δg : une réaction d'oxydation inhibée par l'histidine était attribuée à cette forme d'O2. Mais l'importance biologique de cet acide aminé est un argument pour justifier le concept attribuant des propriétés bio-destructrices à 1Δg. L'attaque de l'histidine se fait via la formation d'un endoperoxyde (1,4-cycloaddition) (fig.27).
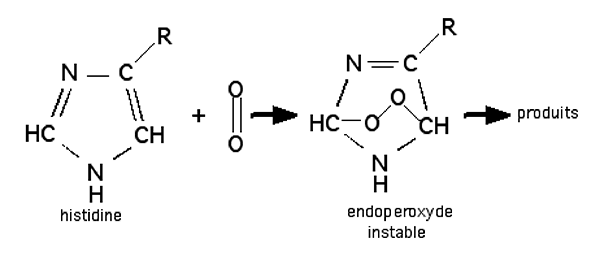
Fig. 27 : Réaction de l'histidine avec l'oxygène singulet (Ryang et Foote,1979, réf ??? )
Le tryptophane : cet acide aminé essentiel est attaqué via la formation d'un dioxétane (fig.28)58. Il s'agit d'une 1,2-cycloaddition. Andersen et al.58 ont montré que le tryptophane quenche la zone rouge du spectre de chimiluminesceence émis par les polynucléaires neutrophiles en phagocytose (B.2.2.3.).
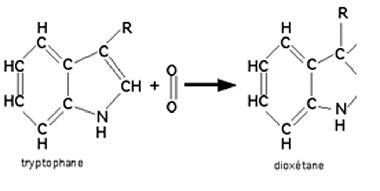
Fig. 28 : Réaction du tryptophane avec l'oxygène singulet59.
La guanosine : comme l'adénine, la cytosine, l'uracile et la thymine, cette base nucléique contient des cycles riches en électrons et réagit donc aisément avec le puissant agent électrophile qu'est l'oxygène singulet60.
Cette molécule est impliquée, non seulement dans les acides nucléiques, mais dans nombre de réactions métaboliques. C'est la partie guanine de la guanosine qui est attaquée par 1Δg(fig. 29)61.
Parmi les nucléosides, 1Δg oxyde presqu'exclusivement les dérivés de la guanine62, produisant le biomarqueur de stress oxydant, la 8-oxo-7,8-dihydro-2’désoxyguanosine (en abrégé : 8oxodGuo).
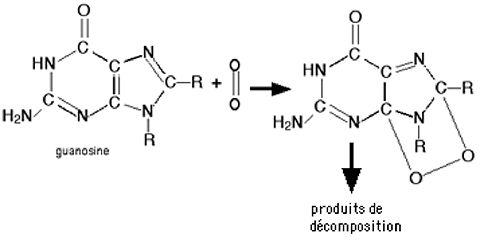
Fig. 29 : Schéma de l'oxydation de la guanosine par 1Δg, obtenu par excitation de l'oxygène par un photosensibilisant63.
Le cholestérol : le cholestérol réagit avec l'oxygène singulet en formant un endoperoxyde qui se rompt et devient un hydroperoxyde (réaction de 1,4-cycloaddition). D'après Girotti64, trois composés sont possibles (fig. 30) :
- le 5α-OOH-cholestérol, le plus abondant,
- le 6α-OOH-cholestérol,
- le 6β-OOH-cholestérol.
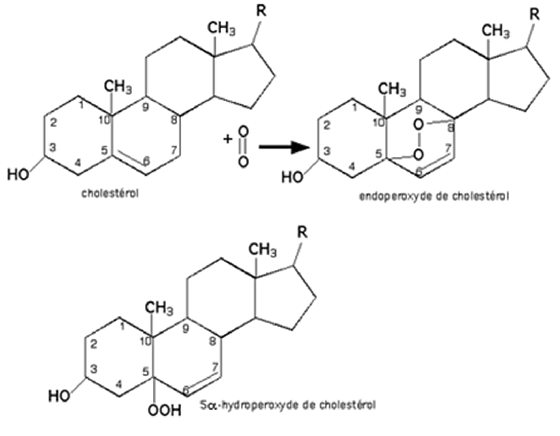
Fig. 30 : Formation du 3ß-hydroxy-5α-cholest-6-ene-5-hydroperoxide (5α-OOH-cholestérol),
par réaction de 1Δg avec le cholestérol via un stade endoperoxyde instable (selon Girotti, réf. 64).
L'acide ascorbique : la vitamine C est un des premiers quencheurs connus de l'oxygène singulet. De nombreux schémas de réaction sont possibles, comme celui de la fig. 3165,66.
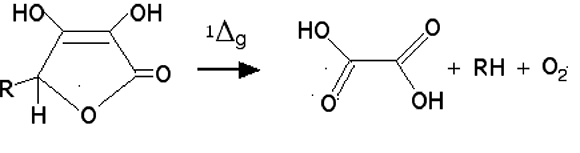
Fig. 31 : L'acide ascorbique utilise l'énergie de 1Δg pour se transformer en oxalate,
tandis que l'oxygène retourne à sa forme fondamentale. R : CH2OH-CHOH-
A.5.2.2. Lipoperoxydations induites par 1Δg
Rawls et Van Santen67 considèraient que l'oxygène singulet est 1500 fois plus efficace que 3O2 au cours de la peroxydation des acides gras polyinsaturés. A cette époque, divers auteurs suggérèrent l'hypothèse d'un passage nécessaire de 3O2 par 1Δg au cours des lipoperoxydations69.
L'intervention de l'oxygène singulet dans les lipoperoxydations induites par la xanthine-oxydase a été suggérée par Pederson et Aust70 qui ont observé une inhibition de celles-ci par le DPBF.
Nous avons plus haut que les "ene-reactions" génèrent des hydroperoxydes (fig. 24). L'addition de la molécule d'oxygène peut se faire à l'une ou l'autre extrémité d'une double liaison qui prend la configuration trans.
A.6. Piègeage et détection de l'oxygène singulet
Ces questions sont traitées dans la partie B de cette étude (L'Oxygène singulet in vivo), à l'article B.1 : méthodes d'étude.